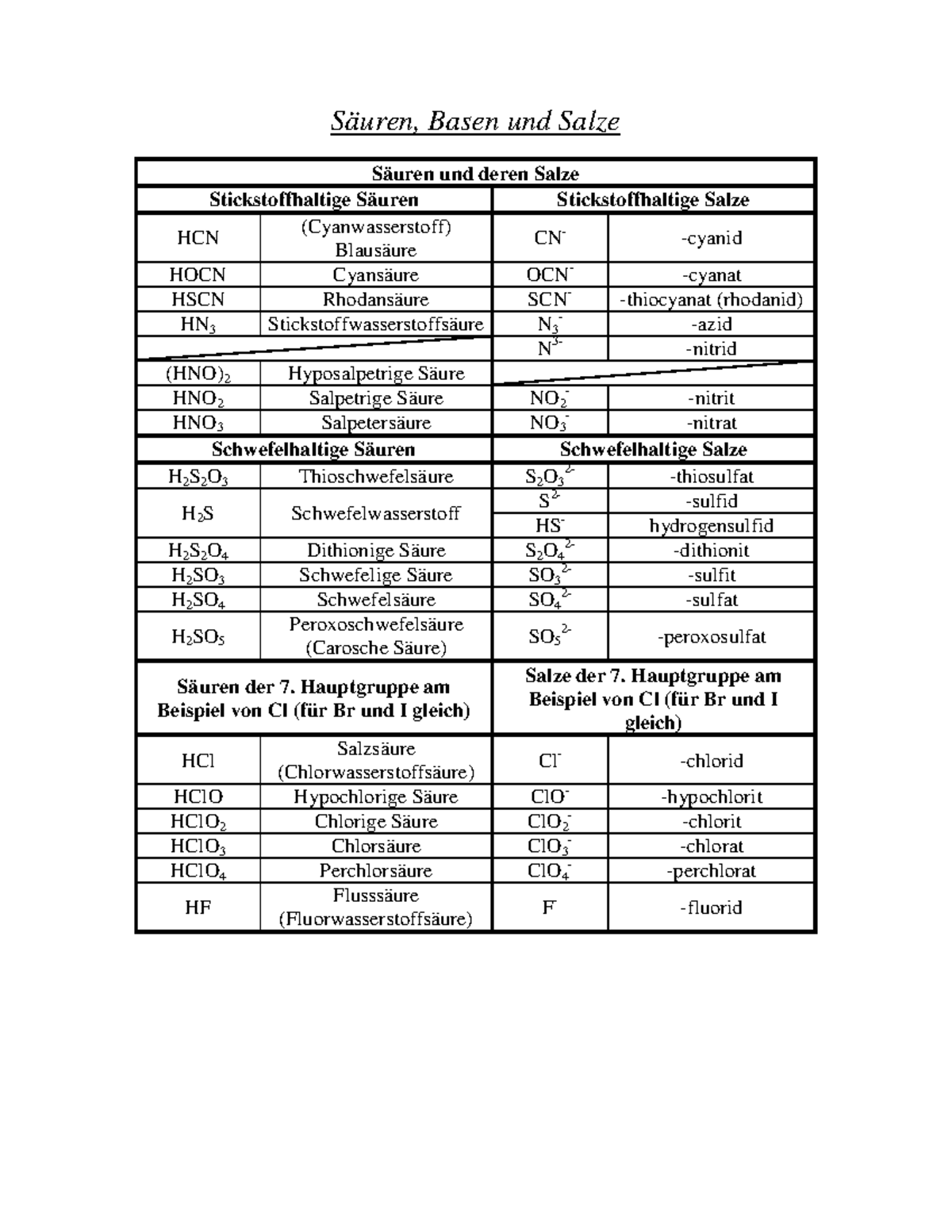
Säuren Basen Salze Zusammenfassung Tabelle Säuren, Basen und Salze Säuren und deren Salze
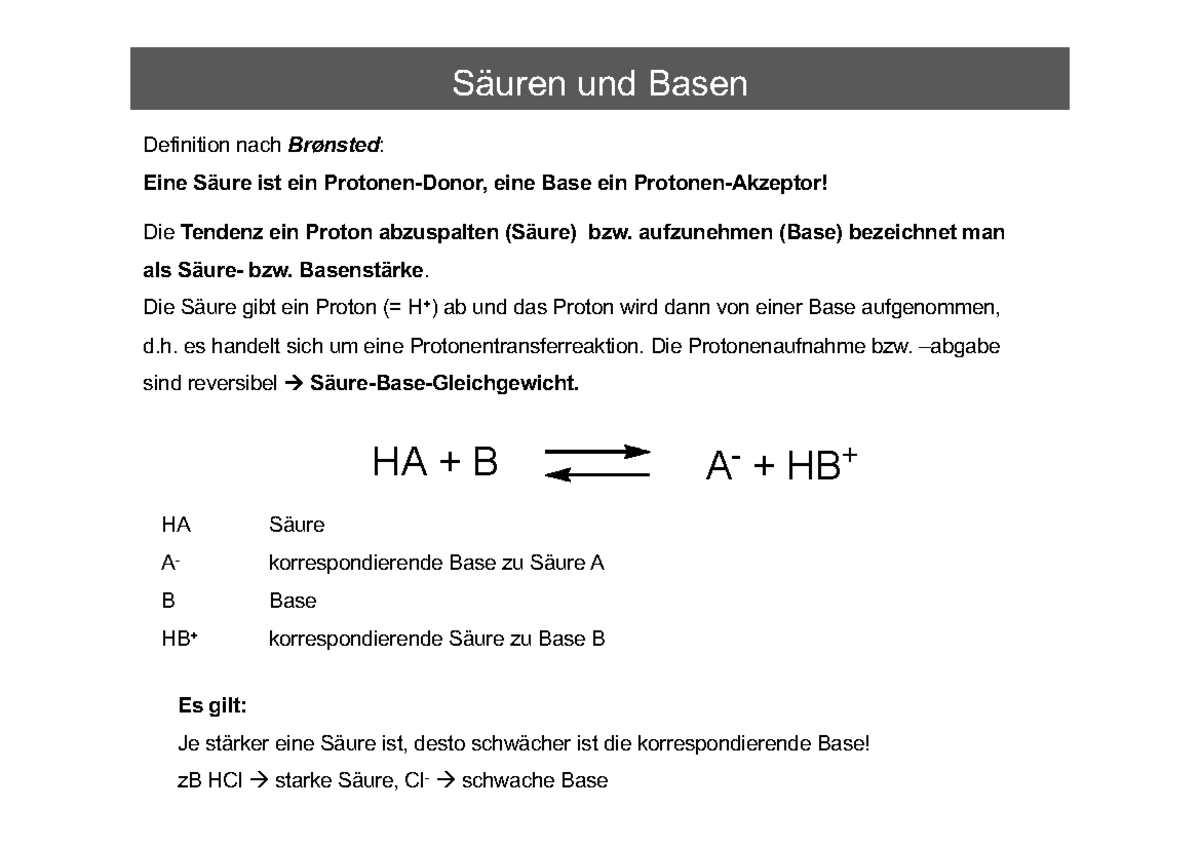
Nach J.N. Brønsted und T.M. Lowry (1923) werden Verbindungen, die H +-Ionen (Protonen) abgeben können, als Säuren (HA) und Stoffe, die H +-Ionen aufnehmen können, als Basen (B) bezeichnet. Bei der Säure-Base-Reaktion stellt sich ein Protolysegleichgewicht ein: HA + B A- + BH +. Für Wasser als Lösemittel kann man schreiben: HA + H 2 O
Übungen zu Kapitel II Säuren und Basen Beantworte folgende

Der Säure/Base-Begriff nach Brönsted. Im Jahr 1923 setzte unabhängig voneinander durch Lowry in Cambridge und Brønsted (deutsche Schreibweise Brönsted) in Kopenhagen die moderne Entwicklung des Säure/Base-Begriffs ein. Zunächst beschäftigte sich der Begriff ausschließlich mit dem System Wasser.
SäureBaseKonzept nach Brönsted YouTube

Brønsted-Säure-Base-Theorie. H 3 O + + Cl - ). Eine Base ist dagegen ein Protonenakzeptor; sie kann durch Aufnahme eines Protons in die entsprechende Säure übergehen (z. B. NH 3 +H 2 O. NH 4+ + OH - ). Die Verknüpfung von Säure und Base, auch Protolyse genannt, erfolgt nach der Beziehung: Säure. Base + Proton.
chemischer unterschied zwischen säuren und basen? (Chemie, Säure)

Bei einer Säure Base Reaktion reagiert die Säure HA zu ihre korrespondierende Base A - und eine Base B wird zu ihrer korrespondierenden Säure HB +. An der allgemeinen Darstellung kannst du sehen, dass ein Proton H + von der Säure zur Base übergeht. Schauen wir uns eine Beispielreaktion von Salzsäure (HCl) mit Wasser (H 2 O) an: HCl + H.
Säuren^JBasen^JSalze Säure, Basen und Salze SäureBaseTheorie nach Brönsted Säuren Stoffe

Säure-Base-Theorie nach Brönsted und Lewis Die Säure-Base-Theorie ist ein fundamentales Konzept in der Chemie, das beschreibt, wie Säuren und Basen miteinander reagieren. Zwei prominente Theorien, die von Johannes Brönsted und Gilbert N. Lewis entwickelt wurden, bieten unterschiedliche Perspektiven auf diese Reaktionen.
PPT Säuren, Basen, Salze PowerPoint Presentation ID842771

Säure-Base-Reaktion. Jede Reaktion, bei der Protonen (Wasserstoff-Ionen) zwischen Reaktionspartnern übertragen werden, heißt Säure-Base-Reaktion. Da keine freien Protonen (Wasserstoff-Ionen) existieren, müssen stets eine Säure und eine Base an der Reaktion beteiligt sein. Die Säure gibt dabei ein Proton ab, welches die Base aufnimmt.
SäureBasenTheorie nach Brønsted 4 Die 10 gängisten Säuren YouTube

Brønsteds Theorie über Säuren. Johannes Nicolaus Brønsted (sprich: Brönsted) erweiterte 1923 den Säurebegriff: "Die den Säuren und Basen gemeinsame Funktion besteht in der Wanderung des Protons." Demnach können Säuren Protonen abspalten (Protolyse) und werden deshalb als Protonendonator bezeichnet. Man bezeichnet dagegen Basen als Protonenakzeptator, weil sie Protonen aufnehmen können.
Säuren und Laugen/Basen Vorbereitung auf den MSA

Säure-Base Theorie nach Brønsted by Hannah Kambocha on Prezi. Blog. April 18, 2024. Use Prezi Video for Zoom for more engaging meetings. April 16, 2024. Understanding 30-60-90 sales plans and incorporating them into a presentation. April 13, 2024. How to create a great thesis defense presentation: everything you need to know.
PPT Säuren, Basen, Salze PowerPoint Presentation ID842771

Wie auch im Video zu Säuren und Basen werden wir uns in diesem Artikel hauptsächlich auf die Definition von Brönsted und Lowry konzentrieren. Demnach gibt eine Säure ein Proton ab und wird dabei zu einer Base. Zusammengefasst gibt es also Protonendonatoren (Protonen abgeben) und Protonenakzeptoren (Protonen aufnehmen).. Die Definition der Brönsted Säure kannst du dir auch an der Reaktion.
Arrhenius Säuren und Basen Erklärung & Übungen

Das Säure-Base-Konzept nach Svante Arrhenius wurde 1887 aufgestellt [1] und basiert auf der Ionentheorie, der experimentell bestimmbaren elektrolytischen Leitfähigkeit von wässrigen Lösungen, die Salze, Säuren oder Basen enthalten. [2] Neben den Salzen, die als echte Elektrolyte bezeichnet werden, sind Säuren potentielle Elektrolyte, da.
Säuren und Basen Theorien Definition nach ARRHENIUS (1883) Wasserstoffverbindungen, die bei

Abb. 3: säure-Base Komplex nach Lewis Bei dieser Säure-Base-Reaktion ist entscheidend, dass eine Kombination zweier Teil-chen durch ein für eine koordinative Bindung zur Verfügung gestelltes Elektronenpaar stattfindet. Zu den Lewis-Säuren zählen: Verbindungen mit unvollständigem Elektronenoktett wie: B(CH 3) 3, BF 3, SO 3, AlCl 3
Säuren und Basen nach Brönsted Chemie Endlich Verstehen YouTube

Arrhenius untersuchte Säuren und Basen in einer wässrigen Lösung.. Du kannst dir auch merken, dass jede Base nach Brönsted auch eine Base nach Lewis ist. Organische Basen. Organische Basen sind beispielsweise die Amine. Sie sind basisch, da diese Stoffgruppe direkt mit dem Ammoniak verwandt ist.
Teil 3 Säuren und Basen Definition nach Brønsted Eine Säure ist ein ProtonenDonor, eine Base
92 IV. Kap. Die Säure-Basen-Definition nach BRÖNSTED. Viertes Kapitel. Die Säure-Basen-Definition nach BRÖNSTED. Eigenschaften von Säuren und Basen. 1. Definition des Begriffs der Säure und Base. Nach der klassischen Definition sind Säuren Substanzen, die in wässeriger Lösung Wasserstoffionen abspalten, während Basen sich durch
SäureBasenTheorie nach Brønsted 2 Dissoziation von Wasser (Ionen) YouTube

Brönsted Säure-Base-Theorie - Das Wichtigste. Nach Brönsted sind Säuren Protonendonatoren und Basen Protonenakzeptoren. Brönsted-Säuren verfügen daher über mindestens ein Proton. Brönsted-Basen benötigen ein freies Elektronenpaar, um das Proton der Brönsted-Säure aufnehmen zu können. Es gilt das Donator-Akzeptor-Prinzip.
SäureBasenTheorie nach Brønsted 8 Basen und Neutralisation YouTube

Lerne wie das Säure-Base-Konzept von Brönsted (Brønsted) funktioniert.Inhalt:00:00 Intro00:05 Säure-Base-Konzept nach Brönsted00:33 Säuren & saure Lösungen01.
06 Säuren und Basen (Definition nach Arrhenius und Brönsted) YouTube

Zusammenfassung. Nach der klassischen Definition sind Säuren Substanzen, die in wässeriger Lösung Wasserstoffionen abspalten, während Basen sich durch eine Dissoziation von Hydroxylionen auszeichnen. Download to read the full chapter text.
.